Εκπαιδευτικό Σεμινάριο «Εισαγωγή στη Βιοεπεξεργασία και τα Βιολογικά φάρμακα»
(“Introduction to Bioprocessing and Biologic Medicines”)
13 Σεπτεμβρίου 2014
Δουβλίνο, Ιρλανδία
National Institute for Bioprocessing Research and Training
Στις 13 Σεπτεμβρίου 2014 πραγματοποιήθηκε στο Δουβλίνο της Ιρλανδίας το Εκπαιδευτικό Σεμινάριο «Εισαγωγή στη Βιοεπεξεργασία και τα Βιολογικά φάρμακα» στο National Institute for Bioprocessing Research and Training (nibrt). Τον Παγκύπριο Σύνδεσμο για την Ελκώδη Κολίτιδα και τη Νόσο του Crohn εκπροσώπησε η Β. Γραμματέας του Συνδέσμου κα Νατάσα-Ρεβέκκα Θεοδοσίου. Σκοπός του εκπαιδευτικού αυτού σεμιναρίου ήταν:
ενημέρωση και η εκπαίδευση για τον τρόπο και τα στάδια παρασκευής των βιολογικών φαρμάκων
- Γνωριμία με τα βιο-παρόμοια* (βιο-ομοειδή/biosimilars) φάρμακα
- Κατανόηση των κανονισμών που διέπουν τα βιολογικά και τα βιο-παρόμοια φάρμακα.
Το Σεμινάριο περιλάμβανε επίσης και ξενάγηση στο εργαστήριο παραγωγής και επεξεργασίας των βιολογικών φαρμάκων.
Ομιλητές: Dr John Milne BSc, PhD και Dr Darine Dempsey, PhD, Senior Regulatory Consultant, The Compliance Group
Βιοτεχνολογία είναι η τεχνολογική εφαρμογή που χρησιμοποιεί βιολογικά συστήματα, ζώντες οργανισμούς ή παράγωγά τους, για να παράξει ή να τροποποιήσει τα προϊόντα ή τις διαδικασίες.
Η παραγωγή των βιολογικών φαρμάκων είναι περίπλοκη, χρονοβόρα και έχει μεγάλο κόστος, όμως έχουν περισσότερα πλεονεκτήματα συγκριτικά με τα παραδοσιακά φάρμακα π.χ. οι θεραπευτικές πρωτεΐνες μπορούν να αλληλεπιδρούν πιο αποτελεσματικά με ένα μεγάλο αριθμό υποδοχέων-στόχων πράγμα που τα παραδοσιακά φάρμακα λόγω της μικρής δομής του μορίου τους δεν μπορούν να πετύχουν. Επίσης, η θεραπεία με βιολογικά φάρμακα επικεντρώνεται στα κύτταρα που έχουν πρόβλημα (target therapy) σε αντίθεση με τα παραδοσιακά χημικά φάρμακα που δρουν σε όλα τα κύτταρα, υγιή και μη. Το κόστος των βιολογικών φαρμάκων είναι αρκετά μεγάλο γιατί η παραγωγή τους γίνεται από ζώντες οργανισμούς οι οποίοι χρειάζονται περισσότερη προσοχή γιατί είναι εύθραυστοι και ευαίσθητοι στις περιβαλλοντικές συνθήκες. Ένα λάθος ή μια παράληψη σε οποιοδήποτε στάδιο της παραγωγής καταστρέφει ολόκληρη την παραγωγή και προκαλεί ζημιά εκατομμυρίων ευρώ στην εταιρεία παραγωγής.
Βιο-παρόμοια φάρμακα σύμφωνα με τον Παγκόσμιο Οργανισμό Υγείας (2009,WHO) είναι τα βιοθεραπευτικά προϊόντα που είναι παρόμοια όσον αφορά την ποιότητα, την ασφάλεια και την αποτελεσματικότητα, με ένα ήδη εγκεκριμένο πρωτότυπο βιοθεραπευτικό προϊόν.
Για να εγκριθεί ένα οποιοδήποτε φάρμακο πρέπει πρώτα να πληροί τέσσερα σημαντικά κριτήρια α) ποιότητα (quality) β) σταθερότητα (stability) γ) αποτελεσματικότητα (efficacy) δ) διεπιστημονικότητα (multidisciplinary).
Βιο-παρόμοια Φάρμακα (Biosimilars):
- Έχουν ομοιότητες με τα βιο-γενόσημα** βιολογικά φάρμακα αλλά δεν είναι βιο- γενόσημα
- Όμοια αλλά όχι ταυτόσημα με τα πρωτότυπα βιολογικά φάρμακα
- Δεν είναι δυνατόν να είναι πανομοιότυπα με τα βιο-γενόσημα φάρμακα
- Ο εκάστοτε κατασκευαστής/ εταιρεία παραγωγής των βιο-παρόμοιων φαρμάκων (biosimilars) δεν έχει πρόσβαση στη διαδικασία που έχει ήδη εγκριθεί για τα βιο- γενόσημα φάρμακα.
- Δεν απαιτείται να αποδειχθεί το όφελος τους στους ασθενείς, αφού αυτό έχει ήδη γίνει για το βιο- γενόσημο φάρμακο.
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) αναφέρει ότι το βιολογικό φάρμακο με την ονομασία Remicade εγκρίθηκε για τη ρευματοειδή αρθρίτιδα, για τη Νόσο του Cronh, για την Ελκώδη Κολίτιδα, για την αγκυλοποιητική σπονδυλίτιδα, ψωριασική αρθρίτιδα και για τη ψωρίαση. Το βιο-παρόμοιο φάρμακο του Remicade είναι το Remsima/Inflectra το οποίο μετά από έρευνες εγκρίθηκε για την αγκυλοποιητική σπονδυλίτιδα και ρευματοειδή αρθρίτιδα. Επίσης, εγκρίνεται η χρήση του και για τη Νόσο του Crohn και την Ελκώδη Κολίτιδα με τη διαφορά ότι για να υπάρξει περισσότερη ελευθερία στη χρήση του χρειάζονται επιπλέον κλινικές έρευνες και αποτελέσματα.
Από την άλλη, ο Αμερικανικός Οργανισμός Φαρμάκων (U.S. FDA) αναφέρει ότι «…δεν θα μπορούσε να συνιστάται λόγω των διαφορών μεταξύ Inflectra και του προϊόντος αναφοράς, που θα μπορούσε να έχει αντίκτυπο στην κλινική ασφάλεια και αποτελεσματικότητα» και ζητά για την έγκριση του και για τις Φλεγμονώδεις Παθήσεις του Εντέρου περαιτέρω έρευνες και αποτελέσματα.
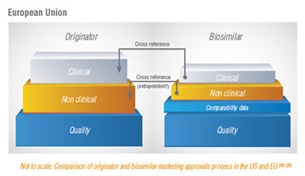
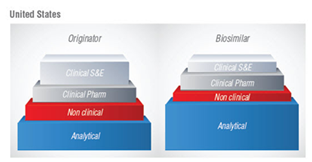
Στις εικόνες 1 και 2 παρουσιάζονται συγκριτικά τα στάδια που ακολουθούνται για να δοθεί η έγκριση για τα βιολογικά και τα βιο-παρόμοια φάρμακα στην Ευρώπη και στην Αμερική. Στην Ευρώπη, όπως φαίνεται στην εικόνα 1, υπάρχει μια μείωση στις κλινικές και μη κλινικές έρευνες όσον αφορά τα βιο-παρόμοια φάρμακα. Συγκεκριμένα, τα βιο-παρόμοια φάρμακα πρέπει να αποδειχτεί ότι δεν έχουν σημαντικές κλινικές διαφορές με το προϊόν αναφοράς , ωστόσο κάποια περιορισμένη διακύμανση επιτρέπεται. Αυτό οφείλεται στο γεγονός ότι η έγκριση για τα βιο-παρόμοια φάρμακα βασίζεται στην απόδειξη της ομοιότητας που έχουν με το ήδη εγκεκριμένο αρχικό προϊόν και όχι μια εκ νέου απόδειξη της ασφάλειας και της αποτελεσματικότητάς τους.
Σημαντική αναφορά γίνεται στο ότι υπάρχουν παθοφυσιολογικές διαφορές μεταξύ των ρευματικών παθήσεων και των Φλεγμονωδών Παθήσεων του Εντέρου όπως επίσης υπάρχει διαφορά και στο προφίλ ασφαλείας τους.
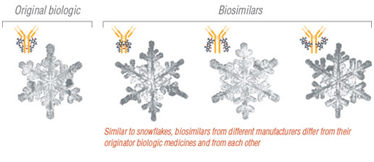 Στη διπλανή εικόνα (εικ.3) παρουσιάζεται σχηματικά τι πάει να πει βιο-παρόμοιο φάρμακο δηλ. είναι αυτό που μοιάζει σε πολλά σημεία με το πρωτότυπο αλλά δεν είναι πανομοιότυπο.
Στη διπλανή εικόνα (εικ.3) παρουσιάζεται σχηματικά τι πάει να πει βιο-παρόμοιο φάρμακο δηλ. είναι αυτό που μοιάζει σε πολλά σημεία με το πρωτότυπο αλλά δεν είναι πανομοιότυπο.
Τώρα, όσον αφορά το θέμα της εναλλαξιμότητας (interchangeability) των βιολογικών φαρμάκων και των βιο-παρόμοιων τους, ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) δεν έχει δώσει κατευθυντήριες γραμμές αλλά αφήνει τις αποφάσεις να παρθούν σε εθνικό επίπεδο. Η κάθε χώρα της Ευρωπαϊκής Ένωσης θα πρέπει να θεσπίσει τους δικούς της κανόνες για το θέμα αυτό. Περισσότερες από 12 χώρες σε όλη την Ευρώπη έχουν θεσπίσει κανόνες για να αποτρέψουν την αυτόματη αντικατάσταση των βιολογικών φαρμάκων από βιο-παρόμοια φάρμακα. Θα πρέπει να σημειωθεί ότι, ο FDA δηλώνει ότι η βιο-ισοδυναμία των δύο φαρμακευτικών προϊόντων, δεν μπορεί να τα καταστήσει εναλλάξιμα.
Η αντικατάσταση των βιολογικών φαρμάκων με τα βιο-παρόμοια φάρμακα:
α) γενικά δεν επιτρέπεται στην Ευρώπη
β) σε μικρό βαθμό δεν συστήνεται και
γ) τονίζεται ότι η αντικατάσταση των βιολογικών φαρμάκων με τα βιο-παρόμοια είναι διαφορετική διαδικασία από την εναλλαξιμότητα.
Συμπεράσματα:
1. Τα βιολογικά φάρμακα έχουν περίπλοκη διαδικασία παραγωγής που αποτελείται από πολλά στάδια και περίπλοκη δομή (αποτελούνται από μεγάλα μόρια).
2. Το κόστος των βιολογικών φαρμάκων είναι αρκετά μεγάλο γιατί η παραγωγή τους γίνεται από ζώντες οργανισμούς οι οποίοι χρειάζονται περισσότερη προσοχή γιατί είναι εύθραυστοι και ευαίσθητοι στις περιβαλλοντικές συνθήκες. Ένα λάθος ή μια παράληψη σε οποιοδήποτε στάδιο της παραγωγής καταστρέφει ολόκληρη την παραγωγή και προκαλεί ζημιά εκατομμυρίων ευρώ στην εταιρεία παραγωγής.
3. Τα βιο-παρόμοια φάρμακα έχουν σημαντικές διαφορές από τα πρωτότυπα βιολογικά φάρμακα τόσο στη δομή όσο και στη διαδικασία παραγωγής τους. Ανησυχίες εκφράζονται για την ομοιότητα και την συγκρισιμότητα τους με τα πρωτότυπα όπως επίσης και για τις επιπλοκές που πιθανόν να προκύψουν από τη βραχυπρόθεσμη ή και μακροπρόθεσμη χρήση τους.
4. Οι εταιρείες παραγωγής βιο-παρόμοιων φαρμάκων είναι δύσκολο να αναπαράγουν τη σύνθετη διαδικασία παραγωγής των πρωτότυπων βιολογικών φαρμάκων και πόσο μάλλον όταν έχουν μόνο πρόσβαση στο τελικό προϊόν των βιολογικών φαρμάκων και όχι στο προϊόν στα αρχικά στάδια της παραγωγής.
5. Τα βιο-παρόμοια φάρμακα στην παρούσα φάση δεν έχουν χαμηλότερο κόστος από τα γενόσημα βιολογικά φάρμακα.
6. Το θέμα της εναλλαξιμότητας (interchangeability) των βιολογικών φαρμάκων και των βιο-παρόμοιων αφορά την κάθε χώρα ξεχωριστά σύμφωνα με τον Ευρωπαϊκό Οργανισμό Φαρμάκων (ΕΜΑ). Η κάθε χώρα της Ευρωπαϊκής Ένωσης θα πρέπει να θεσπίσει τους δικούς της κανόνες για το θέμα αυτό.
Ο Παγκύπριος Σύνδεσμος για την Ελκώδη Κολίτιδα και τη Νόσο του Crohn, στηριζόμενος στο επιστημονικό εργαστήριο που διοργανώθηκε στο Δουβλίνο από τον Πανευρωπαϊκό Σύνδεσμο ασθενών και στη συνάντηση που θα έχει τις επόμενες μέρες με τη Γαστρεντερολογική Εταιρεία Κύπρου, θα καθορίσει τη θέση του για τα βιο-παρόμοια φάρμακα.
*Biosimilars= Βιο-παρόμοια ή βιο-ομοειδή ή βιο-αντίστοιχα
**Βιο-γενόσημα= Πρωτότυπα βιολογικά φάρμακα
Βιβλιογραφία
1. Εκπαιδευτικό Σεμινάριο “Εισαγωγή στη Βιοεπεξεργασία και τα Βιολογικά φάρμακα” 13 Σεπτεμβρίου 2014, Δουβλίνο, Ιρλανδία -National Institute for Bioprocessing Research and Training (nibrt).
2. “The impact of biosimilars entry in the EU market”, Andalusian School of Public Health, January 2011.
3. Simon D. Roger & Ashraf Mikhail (2007). “Biosimilars: Opportunity or Cause for Consern?” J Pharm Pharmaceut Sci 10 (3): 405-410, 2007.
Μείνετε συντονισμένοι με την ιστοσελίδα του συνδέσμου μας για να ενημερώνεστε για τις εξελίξεις. Εναλλακτικά μπορείτε να κάνετε εγγραφή στο ενημερωτικό μας δελτίο για να σας αποστέλλονται μηνύματα με ηλεκτρονικό ταχυδρομείο.
Νατάσα-Ρεβέκκα Θεοδοσίου
Β. Γραμματέας Δ.Σ. ΠΑ.ΣΥ.Ε.Κ.Κ.
Ακολουθούν μερικά φωτογραφικά στιγμιότυπα από την εκδήλωση: